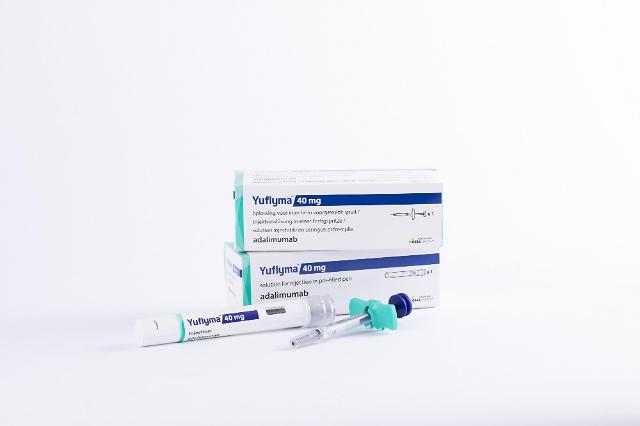
[사진=셀트리온]
임상 3상은 에스토니아, 폴란드 등에서 판상 건선 환자 366명을 대상으로 진행된다. 유플라이마와 휴미라를 여러 차례 교차해 투약한 환자군과 휴미라만 투약한 환자군 등 두 집단 사이의 약물의 유효성과 안전성 등을 비교·검증하는 방식이다.
유플라이마가 휴미라와의 상호교환성을 인정받으면 의사의 개입 없이 약국에서 대체 처방 등이 가능해지고, 휴미라를 투약하던 환자들도 치료 도중에 유플라이마를 처방받는 게 가능해진다.
유플라이마는 지난해 2월 유럽의약품청(EMA)으로부터 허가받은 고농도 휴미라 바이오시밀러로, 저농도 대비 약물 투여량을 절반으로 줄이고 통증을 유발할 수 있는 구연산염을 제거한 게 특징이다. 류머티즘 관절염, 염증성 장 질환, 건선 등 자가면역질환에 쓴다.
셀트리온 관계자는 "유플라이마가 상호교환성 임상을 통해 인터체인저블(interchangeable) 바이오시밀러 지위를 확보하면 시장점유율 확대에 큰 도움이 될 것"이라고 말했다.
Copyright © 이코노믹데일리, 무단전재·재배포 금지



![[세미콘코리아2026] 반도체 경쟁 축, 장비에서 공정 내부 물류로…세미콘서 확인된 자율주행 로봇 전환](https://image.ajunews.com/content/image/2026/02/12/20260212162028118949_388_136.jpg)